Влияние прогестерона на заболевания предстательной железы и перспективы его использования для профилактики и лечения доброкачественной гиперплазии предстательной железы
Наиболее распространенными патологиями предстательной железы у мужчин после 40 лет являются доброкачественная гиперплазия предстательной железы (ДГПЖ) и рак предстательной железы (РПЖ).
Часть 1- эпидемиология и роль некоторых гормонов
Действительно, если в среднем возрасте около 40 лет распространенность ДГПЖ не выходит за 10%, то после 70 лет она встречается у подавляющего большинства мужчин, не менее чем в 80% случаев. Кроме того, ДГПЖ прогрессивно увеличивается в своей распространенности, она стремительно повышает риски малигнизации предстательной железы, а РПЖ является наиболее часто встречающимся раком в мужской популяции и второй причиной смерти от злокачественных неоплазий.
Важно отметить еще один существенный аспект в повышении риска развития РПЖ кроме возраста – этническая принадлежность. Достаточно много работ, демонстрирующих большую предрасположенность к РПЖ темнокожих представителей мужской популяции в сравнении с белыми мужчинами, в том числе называется одна из возможных причин – более высокий уровень эстрадиола у представителей негроидной расы и латиноамериканцев. Хотя достаточно долго основным этническим различием считалась разница в уровне тестостерона и предполагалось, что он существенно выше у представителей негроидной расы или южных стран. И, несмотря на то, что заболевания предстательной железы прогрессивно увеличиваются во всем мире, прорывных открытий в лечении или профилактике пока нет, как нет и новых данных о патогенезе и роли разных гормонов в механизме развития ДГПЖ или РПЖ, в том числе, о роли прогестерона.
ДГПЖ – это увеличение объема простаты, в основе которого лежит, преимущественно, клеточная пролиферация переходной зоны.
РПЖ – это злокачественное перерождение эпителиальных клеток ткани предстательной железы.
По данным ФГБУ «НМИЦ радиологии» МЗ РФ за 15 лет с 2001 года рост РПЖ в РФ увеличился в 5 раз с 10,01 до 57,22 случаев на 100 тысяч населения. С 2016 года в нашей стране отмечено новых 38371 случаев РПЖ, а среднегодовой темп прироста заболеваемости РПЖ составил 7,12% случаев.
Рассматривать патогенез развития ДГПЖ и РПЖ в аспекте всех гормонов не является целью. Но то, что гормоны играют ключевую роль в развитии этих заболеваний, нет сомнений и обозначить широкими мазками то, как действуют разные гормоны в предстательной железе, важно, так как это может помочь осветить действие того гормона, который незаслуженно долго остается в тени, а именно прогестерона.
Андрогены
Андрогены действуют в эпителиальной и стромальной тканях предстательной железы через андрогеновый рецептор, один рецептор на два гормона: тестостерон и дигидротестостерон. Во время полового созревания примерно к 20 годам под действием андрогенов предстательная железа увеличивается с 10 до 20 грамм, а в среднем возрасте начинается пролиферация переходной зоны, окружающей уретру, при том, что уровень андрогенов начинает снижаться .
Гормоны щитовидной железы участвуют в клеточном росте, метаболизме и дифференцировке, в том числе и тканей предстательной железы.
Эпидемиологические исследования показали, что мужчины с ДГПЖ или РПЖ имеют значительно повышенный уровень трийодтиронина (Т3) и тироксина (Т4) и сниженные уровня тиреотропного гормона (ТТГ) у пациентов с ДГПЖ по сравнению с контрольной группой. Также свободный Т3 положительно, а ТТГ отрицательно коррелирует с объемом простаты.
Пациенты с гипотиреозом имеют меньший риск развития РПЖ по сравнению с эутиреоидными мужчинами, что было подтверждено данными метаанализа 2020 года, и в ряде исследований было продемонстрировано, что Т3 увеличивает пролиферацию клеток РПЖ in vitro/in vivo и экспрессию ПСА. Экспериментальные исследования также показали, что тиреоидные гормоны способствуют канцерогенезу, индуцируя ангиогенез . Много ли специалистов эндокринологов, тем более урологов, связывают ДГПЖ с нарушением баланса гормонов щитовидной железы?
Инсулиноподобный фактор роста 1 (ИФР-1) и гормон роста (ГР)
Большое количество исследований показывает, что эндокринная ось ГР-ИФР-1 играет ключевую роль в росте и развитии простаты в нормальной физиологии, а также в патологических состояниях . ИФР-1 секретируется в основном печенью при стимуляции ГР, но он также экспрессируется локально в стромальных и эпителиальных клетках простаты, где он может действовать аутокринным/паракринным образом . Связывание ИФР-1 с рецептором ИФР-1 или рецептором инсулина в предстательной железе активирует путь фосфоинозитид 3-киназы (PI3K)/протеинкиназы B (АКТ) и путь RAF/MAPK, которые способствуют выживанию и пролиферации клеток.
В ряде исследований показана большая распространенность ДГПЖ у пациентов с акромегалией . Они обнаружили, что у пациентов с акромегалией наблюдается более высокий IPSS (International Prostate Symptom Score-международная система суммарной оценки заболеваний предстательной железы), повышенная скорость увеличения простаты при ректальном исследовании и УЗИ, более высокие уровни ПСА и обструктивный паттерн при урофлоуметрии, а также структурные изменения простаты, независимо от их возраста, активности заболевания или гонадного статуса . Эти результаты свидетельствуют о том, что гиперактивация оси ГР/ИФР-1 играет важную роль в патогенезе ДГПЖ у пациентов с акромегалией. Это дополнительно подтверждается уменьшением объема простаты у пациентов с неактивным заболеванием (более 24 месяцев).
Эпидемиологические исследования показали, что высокие уровни циркулирующего ИФР-1 связаны с повышенным риском рака простаты, особенно запущенного заболевания. Более того, экспрессия компонентов осей гормона роста, инсулина и ИФР-1 может тонко модулироваться в простате такими факторами окружающей среды, как диета. Как было описано ранее, было хорошо документировано, что ожирение способствует структурным изменениям в простате.
Недавние исследования выявили участие не только сигнализации ИФР-1, но и самого ГР, который участвует в развитии нескольких опухолей, включая рак простаты. Было показано, что антагонисты соматотропин-рилизинг-гормона напрямую уменьшают объем простаты, не задействуя андрогенный путь. Примечательно, что ИФР-1 обычно снижается с возрастом, хотя метаболические нарушения и акромегалия приводят к увеличению этого гормона, поэтому уровни ИФР-1 следует оценивать у пациентов с заболеваниями простаты, с сопутствующим сахарным диабетом или другими метаболическими изменениями, а также с акромегалией.
Известно, что гиперинсулинемия усиливает пролиферацию эпителиальных клеток простаты in vitro и, наоборот, гипоинсулинемия уменьшает объем простаты. В соответствии с этими результатами, пациенты с уровнем инсулина в сыворотке >13 мЕд/л имеют больший объем простаты и ежегодную скорость роста ДГПЖ по сравнению с пациентами с уровнем инсулина <7 мЕд/л.
Инсулинорезистентность является независимым предиктором развития тяжелых СНМП(синдром нижних мочевых путей). Это может быть связано с гиперактивностью автономной нервной системы, в основном с участием α-адренергического пути, который тесно связан с гиперинсулинемией и участвует в патогенезе СНМП. Повышенный ИМТ >35 кг/м2 был связан с 3,5-кратным повышением риска развития ДГПЖ (>40 мл) и с 1,2-кратным повышением риска развития СНМП по сравнению с теми, у кого ИМТ <25 кг/м2. Данные, полученные у 21694 пациентов, подтвердили эти выводы, показав, что ИМТ является предиктором развития СНМП.
Ряд авторов предложили рассматривать РПЖ, как компонент МС (Метаболического синдрома), поскольку гиперинсулинемия, проспективно, является фактором риска смерти от РПЖ. Долгосрочный анализ выживаемости, проведенный на 2546 пациентах, у которых развился рак предстательной железы, показал, что у пациентов с избыточным весом и высоким уровнем С-пептида риск смертности в четыре раза выше, чем у пациентов с ИМТ <25 кг/м2 и низким уровнем С-пептида, независимо от других клинических предикторов.
Эстрогены
Рецепторы эстрогенов, как ERα, так и ERβ, представлены в простате, что говорит об активности эстрогенов в этом органе. Их место расположения определяет их эффекты. Например, ERα, которые связывают в большей степени с провоспалительными эффектами, в основном находятся в стромальных клетках, и их экспрессия стимулирует рост, как стромальных, так и эпителиальных клеток простаты, в том числе путем воздействия паракринных медиаторов, таких как стромальный bFGF, эпидермальный фактор роста (EGF) и ИФР-1. И именно с активацией этих рецепторов связывают гиперплазию простаты, воспаление и высокий показатель Глисона, а также плохую выживаемость пациентов с РПЖ.
Эпидемиологические исследования подтвердили роль эстрогенов в РПЖ. Афроамериканские мужчины, у которых были выявлены более высокие уровни эстрадиола в сыворотке, представляют повышенный риск развития РПЖ, в сравнении с представителями белой расы. А ERβ, обладающие противовоспалительными свойствами, находятся в эпителиальных клетках, иначе говоря, на рост стромальной ткани они не влияют.
Доклинические и клинические результаты демонстрируют, что агонисты ERβ могут быть эффективны в терапии РПЖ, особенно на ранней стадии. Иначе говоря, эстрогены и ERα, могут рассматриваться, как терапевтическая цель при ДГПЖ. Можно воздействовать на ароматазу, предотвращая конвертацию тестостерона в эстрадиол. Или использовать селективные модуляторы эстрогеновых рецепторов (SERM), которые продемонстрировали антипролиферативное действие на ткань простаты. Также важно отметить, что возрастные изменения половых гормонов, в частности, дефицит тестостерона и повышение уровня эстрогенов, на фоне ожирения, играют ключевую роль в патогенезе возрастных заболеваний предстательной железы.
Лептин, гормон, вырабатываемый адипоцитами, стимулирует рост клеток простаты. Этот эффект может быть связан с тем, что лептин индуцирует экспрессию ароматазы, соответственно, повышая уровень эстрогенов в крови, а их действие в избытке на простату описано выше.
Тестостеронзаместительная терапия и ее влияние на клетки простаты. Приводятся убедительные данные не только безопасного, но и эффективного использования тестостеронзаместительной терапии (ТЗТ) у пациентов с дефицитом андрогенов, метаболическими нарушениями и ДГПЖ, существенно улучшающую качество жизни пациентов, в том числе после операции при РПЖ при соблюдении ряда условий.
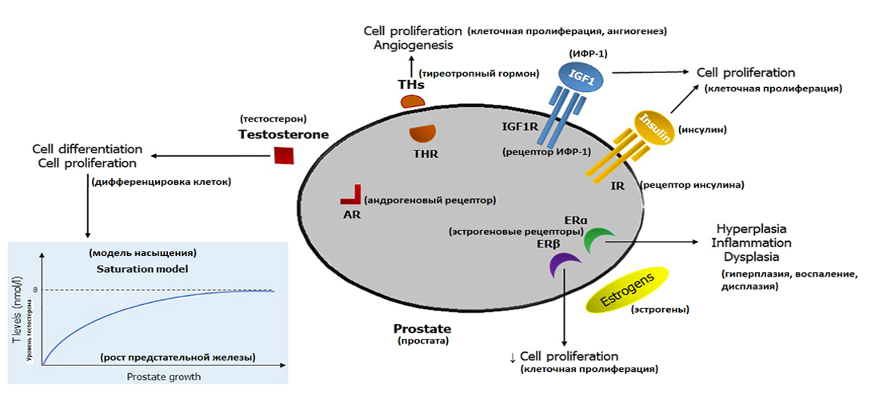
И конечно же, в ткани предстательной железы представлены рецепторы не только перечисленных выше гормонов (см.рис.1), но и других, например, такого, как прогестерон, влиянию которого на предстательную железу, пока, уделено значительно меньше внимания, чем другим гормонам.
Рис.1. Рецепторы к гормонам в тканях предстательной железы и их основное действие на клетки предстательной железы (THs -тиреотропный гормон, THR-рецептор тиреотропного гормона, ERα- α рецептор эстрогенового рецептора, ERβ- β рецептор эстрогенового рецептора, IGF1-ИФР-1-инсулинподобный фактор роста-1, IGFR –рецептор инсулинподобного фактора роста, T levels- уровень тестостерона).
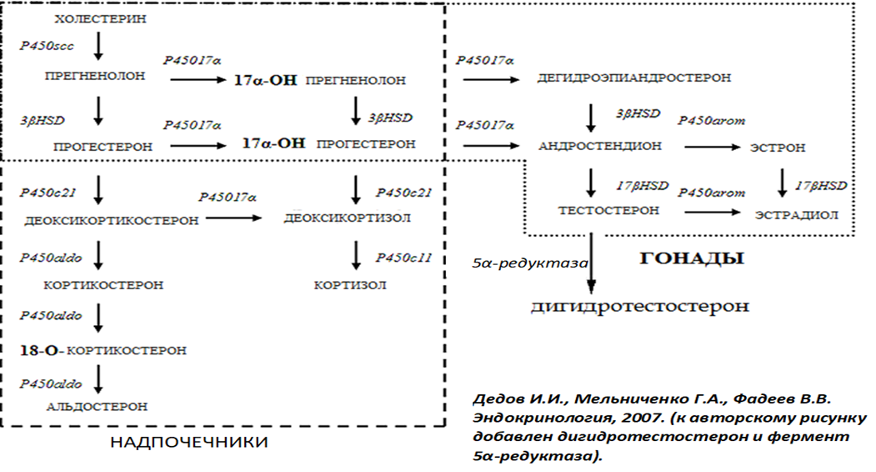
Несмотря на то, что схема стероидогенеза (рис.2) не имеет половых различий, у многих клиницистов гормон прогестерон стойко ассоциируется с функционированием женской половой системы, причем, только в репродуктивном аспекте.
Но, для мужского организма прогестерон также важен, как и для женского, причем, на протяжении всей жизни. Его механизмы действия и эффекты, в том числе и в аспекте ДГПЖ мы рассмотрим подробнее в следующих частях.


